首个拿到FDA新冠自测证的IVD公司,破产!
/ 来源:IVD资讯
近日,据澎湃新闻报道,首个获得美国食品药品监督管理局(FDA)批准的“新冠居家自检测试剂盒”美国制造商申请破产。
2月22日,美国新冠检测试剂制造商 Lucira Health宣布已根据美国破产法向美国特拉华州 破产法院申请保护,破产期间,Lucira Health将继续经营支持客户需求,并寻求业务出售。
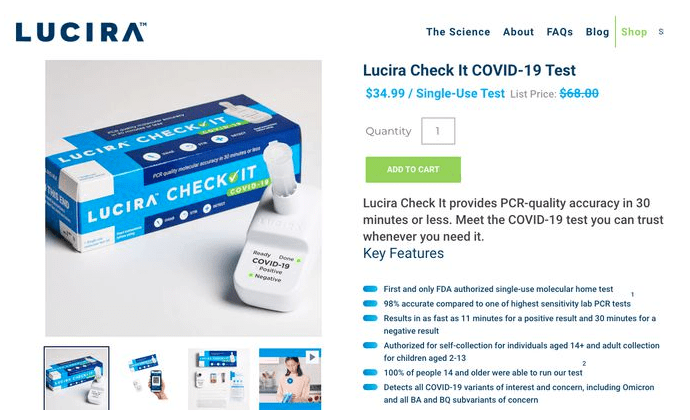
Lucira Health生产的一次性新冠自测试剂盒
Lucira Health成立于2013年2月20日,是一家医疗技术公司,专注于开发和商业化的传染病检测试剂盒。 2020年11月,Lucira Health推出“新冠自测试剂盒”,是首个获得FDA批准的家庭自测试剂盒。
据Lucira Health网站介绍,该一次性新冠自测试剂盒售价为 34.99美元,能够检测出COVID-19变体,包括奥密克戎(Omicron)和BA、BQ变种,阳性最快11分钟出结果,阴性最快可在30分钟内出结果,Lucira Health称自测试剂盒精准度高达98%。
在新冠疫情在世界范围内蔓延,新冠自测试剂盒需求激增,Lucira Health在近几年内获得了迅速发展,并于2021年2月上市。 根据其财务数据的披露,Lucira Health在2021年营收规模为9305万美元,同比暴增34492.94%,净亏损进一步扩大至6482.7万美元,同比增加73.58%。
Lucira Health曾在2022年第一季度短暂地扭亏为盈,随后又陷入亏损中,最新一季度数据为2022年第三季度,营收规模为3439万美元,净亏损高达1.27亿美元。
Lucira Health总裁兼首席执行官Erik Engelson在声明中说道:“随着2022年全球多地疫情政策的优化,我们发现市场对 新冠自测试剂盒的需求有所下降。 再加上为2022-2023年流感季节开发的自测试剂盒,监管审批速度低于预期,导致 收入和资本化不足以抵消支出。”
值得注意的是,2022年10月,Lucira Health为了自救,董事会曾批准了各种方案,以重新平衡Lucira Health的成本结构并寻找新出路,其中 包括成本削减计划、裁员并重新调整了几项供应商协议,以及聘请美国咨询公司Armanino LLP寻求各种战略选择,包括潜在的业务出售。